Investigadores del CNIO han creado el primer modelo animal que reproduce la aparición y el desarrollo de la fibrosis pulmonar idiopática en humanos, que hoy en día carece de tratamiento efectivo y puede ser letal en pocos años. Los resultados sugieren que podría tratarse con terapias basadas en el rejuvenecimiento de los telómeros mediante la activación del enzima telomerasa.
La fibrosis pulmonar idiopática (FPI) provoca una pérdida progresiva de la capacidad respiratoria y puede ser letal en pocos años. Se desconoce su causa, aunque se atribuye a una combinación de genética y ambiente. Un grupo de investigadores del Centro Nacional de Investigaciones Oncológicas (CNIO) demuestra ahora que para que se desencadene la fibrosis pulmonar deben estar afectados los telómeros, las estructuras que protegen los cromosomas.
Es la primera vez que se identifica que un daño en los telómeros causa la enfermedad. El hallazgo abre nuevas vías al desarrollo de terapias en una enfermedad que, hoy por hoy, no tiene tratamiento efectivo. El trabajo, del que son autores Juan M. Povedano y Paula Martínez, del grupo de Telómeros y Telomerasa del CNIO liderado por Maria A. Blasco, así como investigadores de la Unidad de Imagen Molecular del CNIO y de la Universidad Complutense de Madrid, se publica esta semana en Cell Reports.
En la fibrosis pulmonar idiopática —que afecta a unas 8.000 personas en España— el tejido del pulmón va desarrollando cicatrices que lo vuelven rígido y dificultan la respiración. A falta de una causa única y determinante, los investigadores recopilan pistas que iluminan distintas partes del problema. Una es que la exposición a agresiones ambientales, como la radiación, fumar o la polución, aumenta mucho el riesgo.
Otras pistas ya apuntaban a los telómeros. Por ejemplo, muchos pacientes de fibrosis pulmonar idiopática tienen telómeros más cortos de lo normal. Además, la fibrosis pulmonar es una de las enfermedades más frecuentes entre quienes tienen mutaciones en los genes relacionados con el mantenimiento de los telómeros. Estos datos muestran una correlación estadística entre defectos en los telómeros y la enfermedad, pero no una relación causal.
Defectos en los telómeros
En busca de una relación causa-efecto, los investigadores del CNIO crearon un ratón sin una proteína esencial para construir los telómeros en una población de células específica —llamadas células alveolares de tipo II— que es indispensable para regenerar el tejido pulmonar.
El resultado no dejó lugar a dudas: la mayoría de los animales desarrollaron fibrosis pulmonar progresiva y letal. Los investigadores, que comprobaron que la falta de telómeros es letal para las células alveolares de tipo II, interpretan que sin estas células el epitelio pulmonar no puede regenerarse y, por tanto, reparar daños causados por tóxicos ambientales.
Este resultado demuestra por primera vez que el daño proveniente de los telómeros puede provocar fibrosis pulmonar. En palabras de Martínez: "Hemos visto que un daño telomérico agudo es suficiente para desencadenar fibrosis pulmonar, incluso en ausencia de daños ambientales”.
Modelo que reproduce la enfermedad humana
Sin embargo, aunque el ratón sin telómeros en células del epitelio pulmonar demuestra la importancia de los telómeros en el origen de la fibrosis, no reproduce la enfermedad en la mayoría de pacientes humanos.
En la enfermedad en humanos las agresiones ambientales desempeñan un papel importante, y además el problema en los telómeros no es la falta de un gen, sino el acortamiento de los telómeros. Cuando los telómeros se vuelven muy cortos la célula lo interpreta como un daño irreparable y deja de dividirse; si esto ocurre el tejido pulmonar no se regenera, y en cambio se activa un programa de 'protección contra el daño' que incluye la formación de cicatrices –lo que conduciría a la fibrosis–.
Así, los investigadores desarrollaron un modelo animal que combina el acortamiento prematuro de los telómeros debido a la deficiencia de telomerasa con daños ambientales. Como agente causante de daño recurrieron a la bleomicina, un fármaco que daña el material genético de la célula y frena la división celular a dosis altas, pero que a las dosis bajas usadas por los autores, no es suficiente para producir fibrosis pulmonar en los ratones normales.
Comprobaron que hay una sinergia entre las dosis bajas de bleomicina y el derivado de telómeros cortos. El acortamiento de los telómeros no basta para generar la fibrosis, como tampoco, por lo general, la bleomicina a las bajas dosis usadas, pero ambos factores juntos sí desencadenan la enfermedad.
“Estos hallazgos están a favor de un modelo en el que un daño persistente derivado de telómeros cortos o disfuncionales se suma a pequeños daños celulares adicionales y desencadena la fibrosis pulmonar”, añade Povedano.
Los nuevos modelos animales son esenciales para ensayar "estrategias terapéuticas basadas en la activación de la telomerasa [la enzima que repara los telómeros]", concluye el trabajo en Cell Reports.
Vínculo con el envejecimiento
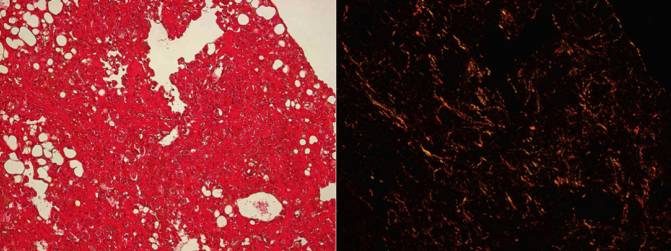
Muestras de pulmones de ratón en las que se visualizan las fibras de colágeno que forman la fibrosis pulmonar. Imagen de campo claro (izquierda) y luz polarizada (derecha). /CNIO
Las nuevas evidencias, que ponen el foco en los telómeros, encajan bien con el hecho de que la fibrosis pulmonar idiopática solo se da en mayores de 50 años, porque es precisamente en los telómeros donde se manifiesta uno de los principales síntomas celulares del envejecimiento. Los telómeros se hacen más cortos cada vez que la célula se divide; a más edad del organismo, más divisiones y más acortamiento de los telómeros.
Para Blasco: "Entender los mecanismos moleculares por los que se produce el envejecimiento, como es el acortamiento de los telómeros, nos ha permitido generar modelos animales que reproducen fielmente enfermedades como la fibrosis pulmonar idiopática, y ya nos está ayudando a probar terapias que esperamos sean efectivas y que están basadas en el rejuvenecimiento de los telómeros mediante la activación del enzima telomerasa".
Referencia bibliográfica:
Juan M. Povedano, Paula Martinez, Juana M. Flores, Francisca Mulero, Maria A. Blasco. Mice with pulmonary fibrosis driven by telomere dysfunction. Cell Reports (2015). doi: 10.1016/j.celrep.2015.06.028
Estudio financiado por el Ministerio de Economía y Competitividad, la Unión Europea y la Fundación Botín y Banco Santander, a través de Santander Universidades.