Contrariamente a los humanos y otros mamíferos, las salamandras no pueden quedarse tuertas, ni mancas, ni cojas. Gracias a una excepcional habilidad, son capaces de regenerar una y otra vez hasta su cerebro, corazón y médula espinal, una destreza que ni siquiera pierden cuando llegan a la edad adulta. Un nuevo estudio revela por qué estos anfibios, protagonistas de nuestro #Cienciaalobestia, se han convertido en las estrellas del crecimiento de miembros perdidos.
Imagina perder un ojo o un brazo. Tu cuerpo reaccionaría cerrando la herida con una cicatriz y un muñón, como ocurre con otros mamíferos, pero en ningún caso, el miembro perdido se regeneraría. Esto solo lo logran las salamandras y los tritones (familia Salamandridae), que han desarrollado estrategias únicas que les permiten regenerar una y otra vez los tejidos perdidos, incluso en edad adulta.
Ningún otro animal puede igualar sus habilidades regenerativas en extremidades, cola y médula espinal, partes del ojo (retina y lentes), cerebro, corazón y mandíbula, sobre todo al pasar a la edad adulta. El ajolote (Ambystoma mexicanum), una salamandra mexicana, por ejemplo, pierde esta habilidad una vez que se produce la metamorfosis de larva a juvenil.
Las salamandras se convierten en las reinas del crecimiento de miembros perdidos gracias a un mecanismo de regeneración que es diferente en el estadio larval y una vez que la metamorfosis se produce. Así lo revela un equipo de científicos, liderado por la Universidad de Tsukuba (Japón), en la revista Nature Communications.
“Las salamandras cambian de mecanismo celular para la regeneración de extremidades desde uno basado en células madre musculares cuando son larvas, a otro basado en fibras musculares esqueléticas, cuando pasan la metamorfosis”, explican los autores en el estudio.
Los investigadores confirman que estos anfibios han desarrollado estrategias innovadoras para asegurar su habilidad de regeneración de extremidades cuando se desarrollan de larvas a adultos.
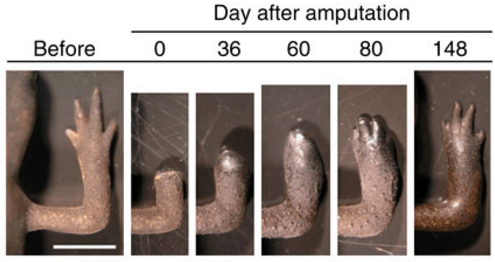
Regeneración de una pata de salamandra transgénica tras su amputación para el estudio. / Hibiki Vincent Tanaka et al.
Un antes y un después de la metamorfosis
El hallazgo se ha producido gracias al uso de tritones de vientre de fuego japoneses (Cynops pyrrhogaster) transgénicos, cuyo uso no había sido posible hasta hace poco. Con estas salamandras endémicas de Japón, los científicos pudieron monitorizar diferentes tipos de células musculares durante la regeneración de extremidades antes y después de la metamorfosis de los anfibios.
Cuando una salamandra pierde por ejemplo una pata, una masa de células, llamada blastema, es regenerada en el muñón, a partir del cual se crea una nueva extremidad totalmente funcional. Hasta ahora se había sugerido que las fibras musculares esqueléticas –que forman los músculos esqueléticos– o las células madre musculares (células progenitoras) –precursoras inactivas de las fibras musculares que se localizan en su interior– contribuían a la regeneración del nuevo músculo del miembro de la salamandra.
El nuevo trabajo demuestra que cuando los tritones son larvas usan células madre musculares como células capsulares para crear el nuevo músculo en una extremidad regenerada. En el caso de los anfibios adultos, estos ‘reclutan’ fibras musculares esqueléticas en el muñón para el mismo propósito.
Para el estudio, los científicos insertaron en los embriones unicelulares de salamandras un gen activo en las fibras musculares, y monitorizaron a los animales hasta los tres meses de edad, momento en el que las larvas empiezan a nadar, y hasta los 16 meses, cuando se produce la metamorfosis a juveniles.
Los anfibios transgénicos empleados para el estudio fueron anestesiados antes de amputarles los miembros y así se pudo comprobar el crecimiento del músculo en cada caso. El equipo descubrió además que la piel, los huesos, y los tejidos nerviosos también se regeneraron por sí mismos.
Según la universidad japonesa, pionera en el desarrollo de técnicas para la creación de salamandras transgénicas, los mecanismos de estas estrategias “proporcionarán indudablemente claves para la regeneración en otras especies, incluidos los mamíferos”, concluyen los autores.
Referencia bibliográfica:
Hibiki Vincent Tanaka et al. “A developmentally regulated switch from stem cells to dedifferentiation for limb muscle regeneration in newts” Nature Communications7(11069) 30 de marzo de 2016 doi:10.1038/ncomms11069