Un equipo internacional de científicos ha logrado por primera vez corregir en embriones humanos, mediante la herramienta de edición genética CRISPR Cas9 y de modo eficaz, una mutación que causa una alteración grave: la miocardiopatía hipertrófica. Este polémico experimento, realizado en EE UU con más de un centenar de embriones, abre enormes posibilidades en el campo de la fecundación in vitro y el tratamiento de enfermedades hereditarias.
Científicos de EEUU, China y Corea del Sur acaban de presentar en la revista Nature una forma eficiente de usar la novedosa herramienta de corta-pega genético CRISPR Cas9 para corregir en embriones humanos la mutación de un gen (MYBPC3) asociada a una enfermedad hereditaria: la miocardiopatía hipertrófica, que afecta a aproximadamente a una persona de cada 500 y que puede causar muerte súbita en deportistas jóvenes.
El avance aporta una nueva vía, más segura y eficaz que otras anteriores, para editar el ADN en la línea germinal humana (óvulos, esperma y embriones en sus etapas iniciales), por lo que las modificaciones se transmiten a las siguientes generaciones. Sin embargo, los autores son prudentes: “Todavía quedan muchas cuestiones por resolver antes de su aplicación clínica, como saber si se puede usar la misma técnica para otras mutaciones”.
“Necesitamos más investigación básica de este tipo para recoger toda la información que nos ayude a tomar decisiones sobre cómo aplicar esta tecnología”, señala a Sinc uno de los autores, el español Juan Carlos Izpisua Belmonte, profesor del Gene Expression Laboratory del instituto Salk (EE UU), e insiste: “Tendremos que revisar otras mutaciones para confirmar la alta eficiencia y seguridad de la técnica”.
Hasta ahora se han identificado más de 10.000 alteraciones hereditarias controladas por un solo gen, como en este caso. Heredar una sola copia de la mutación en el gen MYBPC3 puede derivar en el desarrollo de la miocardiopatía hipertrófica. De momento, los tratamientos actuales alivian sus síntomas, pero no abordan la causa genética que está detrás.
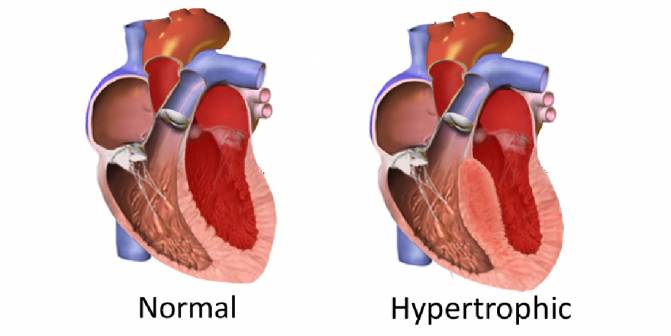
Diferencia entre un corazón normal y otro con hipertrófia. / IBS, South Korea
Uno de los métodos más utilizados para prevenir mutaciones perjudiciales que, como esta, se transmiten a la descendencia, es el diagnóstico genético preimplantacional (DGP), con el que se separan los embriones que no tienen la mutación perjudicial para transferirlos a un ciclo de fecundación in vitro.
Pero en los últimos años ha llegado la herramienta de edición genética CRISPR-Cas9, desarrollada por las investigadoras Jennifer Doudna y Emmanuelle Charpentier tras los estudios pioneros del español Francisco Mojica, ofreciendo la posibilidad de corregir mutaciones causantes de enfermedades hereditarias directamente en embriones humanos.
Embriones humanos libres de la mutación genética
Eso es lo que ha realizado ahora el equipo internacional liderado por el investigador Shoukhrat Mitalipov, del Centro de Células Embrionarias y Terapia Génica de la Oregon Health & Science University (OHSU, en EEUU), evaluando la seguridad y la eficiencia de la corrección efectuada en el gen MYBPC3.
“Cada generación llevaría esta reparación porque hemos eliminado del linaje familiar la variante del gen que causa la enfermedad”, destaca Mitalipov, quien subraya: "Usando esta técnica es posible reducir la carga de esa enfermedad hereditaria en la familia y eventualmente en la población humana”, subraya.
Para sus experimentos, los científicos trabajaron in vitro con 142 embriones humanos en estados iniciales de desarrollo (oocito, blastocisto) y nunca los llegaron a implantar. En concreto, emplearon inicialmente 167 óvulos donados por mujeres sanas, de los cuales consiguieron fertilizar los 142 con el esperma de un solo donante: un hombre portador de una mutación heterocigótica en el gen MYBPC3, es decir, con una copia mutada dominante y otra correcta. De esta forma, sin ninguna intervención, se esperaría que un 50% de los ovocitos fecundados estuvieran libres de la mutación.
Un resultado sorprendente
Pero cuando a una parte de los embriones se les aplicó la técnica CRISPR Cas9 ese porcentaje se elevó significativamente. Se logró cortar la secuencia del gen mutante y se observó cómo los embriones humanos eran capaces de reparar bien el ADN. Uno de los resultados más sorprendentes es que, en la mayoría de los casos, las roturas se repararon de forma eficiente utilizando a modo de espejo la copia no mutada del gen de la donante, en lugar de emplear como plantilla un ADN sintético.
Así, se consiguió que más de dos tercios de los embriones objetivo contuvieran las dos copias libres de errores del gen. La tecnología CRISPR con su enzima Cas9 seccionó el ADN en la posición adecuada en todos los embriones testados en esta parte del experimento, donde 42 de los 58 (un 72,4%) embriones analizados no llevaban la mutación de la cardiomiopatía hipertrófica. En otras palabras, la técnica incrementa la probabilidad de heredar el gen correcto desde el 50% al 72,4%.
Científicos chinos ya había aplicado en tres trabajos anteriores la tecnología CRISPR para tratar enfermedades en embriones humanos, pero de una forma ineficiente, ya que aparecía lo que se denomina ‘mosaicismo’, con embriones formados por células de dos o más tipos genéticamente diferentes.
Solución al mosaicismo
“La principal contribución de nuestro estudio ha sido desarrollar una estrategia para evitar el mosaicismo y hacer que los efectos fuera del objetivo marcado sean despreciables, gracias a la inyección conjunta del esperma y los componentes de edición genética (en oocitos no fecundados en la denominada fase M)”, destaca Izpisua Belmonte. En los trabajos anteriores los componentes CRISPR-Cas9 se añadían en una etapa posterior, cuando ya estaba fertilizado el oocito.
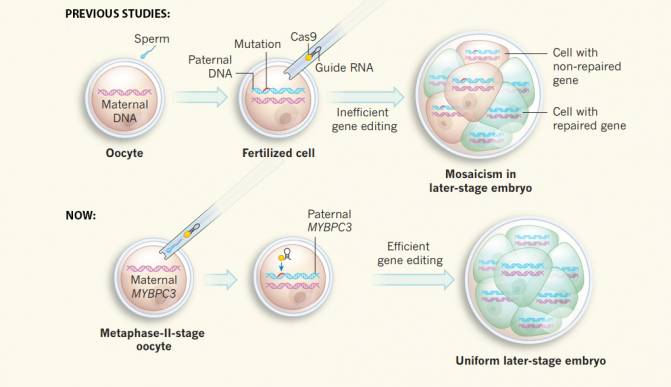
En estudios anteriores primero se fertilizaba el óvulo con el esperma y luego se añadían los componentes de edición genética, pero ahora se inyectan a la vez que el esperma, con resultados más eficientes y sin mosaicismo. / Nerges Winblad & Fredrik Lanner/Nature
Según los autores, el trabajo indica que este tipo de edición genética en embriones humanos es efectivo y muy preciso, brindando ciertas garantías con respecto a las preocupaciones que existen sobre su seguridad. Además, no detectaron mutaciones no previstas. Por tanto, este enfoque se podría aplicar potencialmente –junto a otras técnicas como la DGP–, para corregir las miles de alteraciones genéticas que afectan a millones de personas en todo el mundo, sin transmitirlas a sus descendientes. "Confío en que se pueda aplicar a cualquier embrión con mutaciones autosómicas dominantes heterocigóticas", apunta el investigador español.
La herramienta también podría aumentar el éxito de la fecundación in vitro al incrementar el número de embriones sanos. “Si se confirma que es segura, esta técnica podría reducir el número de ciclos necesarios para las personas que intentan tener hijos libres de enfermedades genéticas”, señala Paula Amato, coautora y profesora de obstetricia y ginecología de la escuela de Medicina de la OHSU.
Por su parte, Daniel Dorsa, vicepresidente senior de investigación de la OHSU, concluye: “Las consideraciones éticas para trasladar esta tecnología a ensayos clínicos son complejas y merecen un compromiso público importante antes de que podamos responder a la pregunta más amplia de si resulta de interés para la humanidad alterar los genes humanos para las futuras generaciones”. El debate sobre este polémico experimento, que sería ilegal en países como España, queda abierto.
Referencia bibliográfica:
Hong Ma, Nuria Marti-Gutierrez, Sang-Wook Park, Jun Wu, Yeonmi Lee , Keiichiro Suzuki, Amy Koski, Dongmei Ji , Tomonari Hayama, Riffat Ahmed, Hayley Darby, Crystal Van Dyken, Ying Li, Eunju Kang, A.-Reum Park, Daesik Kim, Sang-Tae Kim , Jianhui Gong, Ying Gu, Xun Xu, David Battaglia, Sacha A. Krieg, David M. Lee, Diana H. Wu, Don P. Wolf, Stephen B. Heitner, Juan Carlos Izpisua Belmonte, Paula Amato, Jin-Soo Kim, Sanjiv Kaul & Shoukhrat Mitalipov. “Correction of a pathogenic gene mutation in human embryos”. Nature, 2 de agosto de 2017. Doi:10.1038/nature23305.