El equipo de María Blasco en el CNIO muestran cómo el tratamiento con rapamicina, una estrategia antienvejecimiento que alarga la vida en ratones normales, es dañina cuando los animales poseen telómeros cortos en sus cromosomas. El hallazgo ayuda a entender enfermedades como la anemia aplásica y la fibrosis pulmonar.
En las últimas décadas se ha descubierto que la velocidad a la que envejecemos está muy influida por procesos bioquímicos que, al menos en animales modelo, es posible controlar en el laboratorio.
El acortamiento de los telómeros es uno de estos procesos; otro, la capacidad de las células para detectar nutrientes mediada por la proteína mTOR. Alterando uno u otro se ha logrado prolongar la vida en muchas especies.
Ahora, un equipo del Centro Nacional de Investigaciones Oncológicas (CNIO) ha estudiado por primera vez qué ocurre al manipular ambos y han observado que bloquear la detección de nutrientes con rapamicina –un inhibidor de mTOR– retrasa el envejecimiento de los ratones sanos, pero empeora las enfermedades y la vejez prematura que sufren los roedores con telómeros cortos.
Esto tiene implicaciones importantes en el tratamiento de enfermedades asociadas a dichos telómeros cortos, como algunas patologías del envejecimiento. El trabajo, del Grupo de Telómeros y Telomerasa que dirige María Blasco, se publica en la revista Nature Communications.
Los telómeros, en los extremos de los cromosomas, preservan la información genética de las células. Con la edad se van acortando, hasta un momento en que ya no cumplen su función, las células dejan de dividirse y los tejidos, incapaces de regenerarse, envejecen.
La capacidad de las células para detectar nutrientes, por su parte, depende de una cascada de señales bioquímicas que activa la proteína mTOR. Es una vía molecular esencial porque controla el crecimiento de las células –y de todo el organismo–.
Además, tiene un papel central en el envejecimiento: si la vía mTOR se bloquea, el envejecimiento se frena. Pero esto solo se había demostrado en ratones jóvenes y sanos, no en ratones con telómeros cortos, asociados al envejecimiento y a determinadas enfermedades llamadas síndromes teloméricos.
Un inhibidor de mTOR es la rapamicina, un fármaco que prolonga la vida en levaduras, moscas, gusanos y ratones, y que reduce significativamente la incidencia de cáncer en ratones con telómeros normales.
Los investigadores querían probar si la rapamicina podría alargar también la vida de los ratones con telómeros cortos, pero han descubierto que ocurre lo contrario: envejecen hasta un 50 % más rápido.
Este hallazgo básico ha permitido a los autores descubrir que, de hecho, mTOR es importante para la supervivencia de ratones con telómeros cortos y que, por tanto, su bloqueo es negativo.
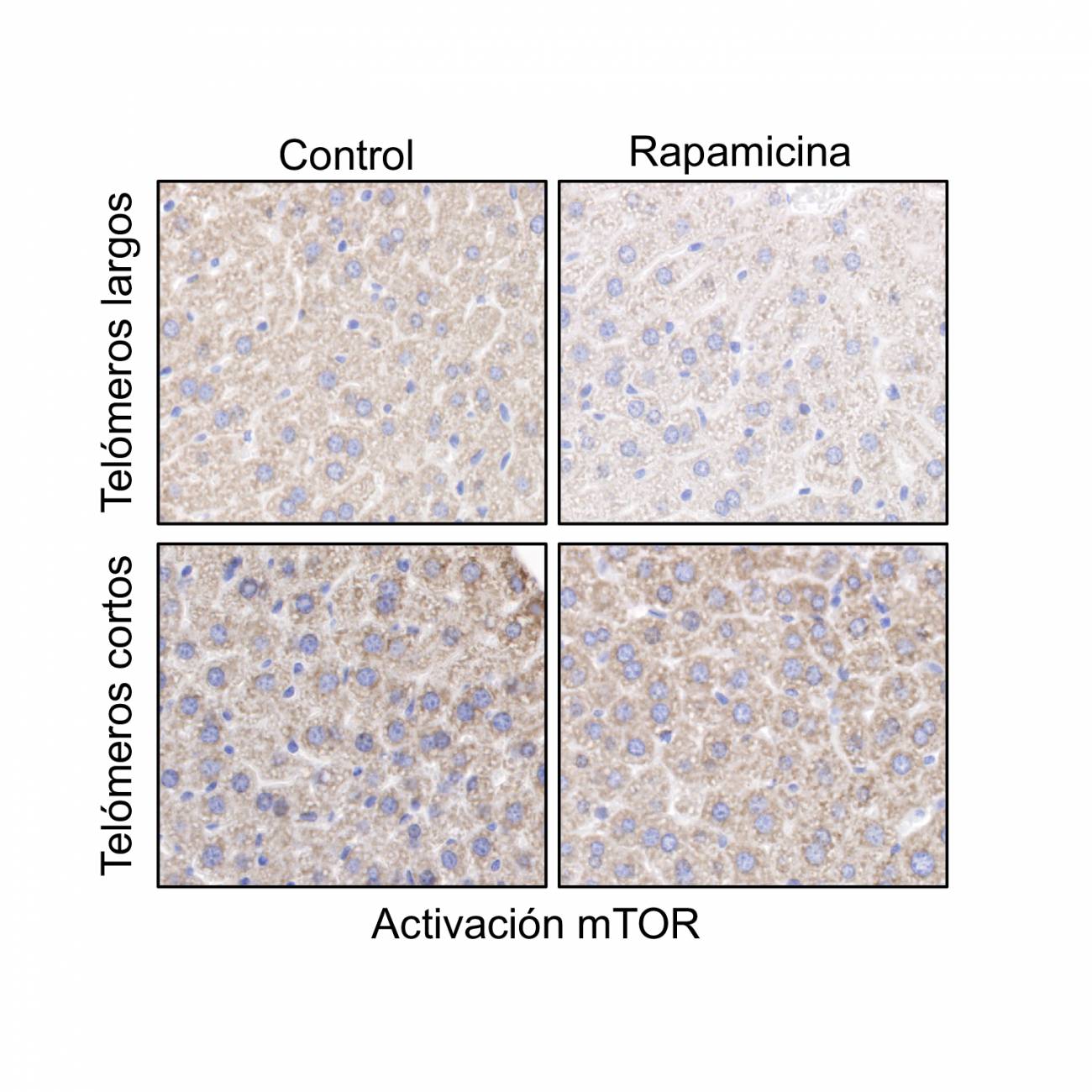
La rapamicina inhibe la actividad de mTOR en muestras de hígado de ratones con telómeros largos, pero no en ratones con telómeros cortos. / CNIO
Pero además tiene implicaciones clínicas. Los telómeros cortos se asocian o son la causa de los llamados síndromes teloméricos, enfermedades como la disqueratosis congénita, la anemia aplásica, las fibrosis pulmonar y hepática y otras enfermedades degenerativas que hoy día apenas tienen tratamiento.
El bloqueo de la vía mTOR con rapamicina se consideraba una posible estrategia contra estas enfermedades, pero los resultados del trabajo apuntan a que no funcionaría e incluso podría ser pernicioso.
“A la vista de los efectos beneficiosos pro longevidad de la inhibición de la vía mTOR, nos preguntamos si el tratamiento con rapamicina también mejoraría la vejez prematura y la menor longevidad de los ratones con telómeros cortos”, escriben los autores.
Pero, si bien en los ratones control [con telómeros normales] la rapamicina aumentó la longevidad, en los ratones con telómeros cortos la redujo. “Estos resultados son de interés clínico para las enfermedades humanas en que los pacientes tienen telómeros críticamente cortos”, explican las autoras María Blasco y Paula Martínez.
Otra sorpresa para los investigadores fue descubrir que, en los ratones con telómeros cortos, la vía mTOR está sobreactivada, es decir, sus células son más sensibles de lo habitual a la presencia de alimento.
Los autores interpretan que es precisamente la mayor capacidad de detección de nutrientes lo que permite sobrevivir a estos ratones, una conclusión inesperada que podría abrir nuevas vías de investigación en el tratamiento de los síndromes teloméricos.
“Este descubrimiento indica que la sobreactivación de la ruta mTOR es necesaria para compensar los problemas derivados de tener unos telómeros cortos”, afirma Blasco.
De hecho, se sabe que mTOR también está sobreactivada en algunos órganos de ratones de edad avanzada, lo que podría indicar que este es un fenómeno asociado no solo al envejecimiento anormalmente acelerado, sino al fisiológico natural.
Referencia:
The mTOR pathway is necessary for survival of mice with short telomeres. Iole Ferrara-Romeo et al (2020). DOI: 10.1038/s41467-020-14962-1
El estudio ha sido financiado por el Ministerio de Ciencia, Innovación y Universidades del Gobierno de España, el Instituto de Salud Carlos III, la Comunidad de Madrid, Fundación Botín y Banco Santander a través de Santander Universidades y World Cancer Research.