A partir de compuestos inspirados en la naturaleza, investigadores de EE UU y Alemania han creado moléculas ‘quimera’ capaces de inducir el corte de ARN oncogénicos, como el del gen MYC, que impulsa el crecimiento desenfrenado de las células cancerosas.
El gen del cáncer MYC ha sido bautizado como el 'monte Everest' de la investigación oncológica debido a la dificultad de diseñar medicamentos que puedan desactivarlo y a la expectativa de que un fármaco eficaz contra él pudiera ayudar a tantos enfermos de cáncer.
Ahora, una colaboración entre científicos especializados en ARN, químicos y biólogos del cáncer de EE UU y Alemania ha escalado un buen tramo hacia la cima, abriendo al mismo tiempo nuevas rutas para llegar a la cumbre de otras enfermedades igualmente difíciles de tratar. Su estrategia la presentan en Nature.
El enfoque de los científicos dirige las enzimas de reciclaje de las células hacia el ARN (mensajero y otros) de los genes asociados al cáncer y corta segmentos clave para impedir que hagan daño. La táctica funcionó contra el gen del cáncer MYC, y también contra otros dos que suponen todo un reto: JUN y MIR155. Estos tres genes regulan la transcripción de otros, desencadenando un rápido crecimiento tumoral.
"Para los pacientes con cáncer cuya enfermedad está provocada por estos oncogenes comunes pero difíciles, el método del degradador de ARN puede ofrecer nuevas esperanzas", afirma el coautor Herbert Waldmann, director del Instituto Max Planck de Fisiología Molecular en Dortmund (Alemania).
El estudio también abre nuevas posibilidades para dirigir medicamentos contra el ARN, lo que potencialmente abre muchas otras enfermedades genéticas a este tipo de tratamiento, añade Matthew D. Disney de The Herbert Wertheim UF Scripps Institute for Biomedical Innovation & Technology (EE UU).
"Hemos descubierto unas 2.000 nuevas estructuras de ARN capaces de unirse a pequeñas moléculas similares a fármacos e identificado seis nuevos 'quimiotipos' capaces de unirse al ARN", explica Disney, "básicamente, hemos creado una enciclopedia de ‘pliegues’ de ARN susceptibles a los fármacos".
Entre las dianas farmacológicas más difíciles, el gen MYC también es uno de los más importantes. Su activación puede afectar al 70 % o más de todos los cánceres humanos (como los de mama, pulmón, estómago o colon). Puede dirigir la construcción o el silenciamiento de muchos otros genes.
Afecta al crecimiento celular e incluso a un programa de suicidio celular que lleva a las células dañadas a autodestruirse, un proceso vital llamado apoptosis. También influye en el proceso de reparación del ADN dañado y el crecimiento de los vasos sanguíneos. En muchos cánceres MYC está sobreexpresado, lo que lleva a las células a crecer y dividirse con demasiada rapidez.
Por su parte, la activación de otro gen asociado al cáncer, JUN, se ha observado en más de 20 tipos de tumores diferentes, como el glioblastoma, el cáncer de mama, de próstata, de pulmón y colorrectal, entre otros.
En cuanto al pequeño gen ARN llamado MIR155, impulsa la inflamación y el crecimiento y la propagación de muchos tipos de cáncer. Los investigadores lo han encontrado activado en los de mama, riñón, gástrico y otros.
Hasta ahora, los esfuerzos por fabricar fármacos que impidan que los tres oncogenes causen daños han fracasado, en gran medida, debido a sus complejos diseños estructurales.
Para superar estos retos fue necesario el esfuerzo de un equipo internacional de tres laboratorios: en Florida, el grupo de D. Disney aportó conocimientos sobre el descubrimiento de fármacos para estructuras de ARN y nuevas tecnologías de degradación del ARN.
En el Instituto Max Planck de Fisiología Molecular, el grupo de Waldmann diseña compuestos inspirados en sustancias naturales, como los que han inspirado muchos antibióticos y fármacos contra el cáncer.
Por su parte, el doctor Frank Glorius, químico orgánico del Instituto de Química Orgánica de la Universidad de Münster (Alemania), ha desarrollado métodos innovadores para construir nuevas moléculas similares a fármacos. Algunos de sus compuestos, presentes en la colección de Waldmann, se diseñaron específicamente para influir en la biología de las membranas celulares.
Los compuestos derivados del imidazol, una molécula habitual en productos naturales y fármacos, modificados con cadenas de carbono, resultaron ser los más eficaces a la hora de unirse a los ARN ligados al cáncer.
"Los compuestos se parecen un poco a un televisor con dos patas largas y finas", explica Glorius.
"Ha sido una auténtica colaboración", añade Waldmann, y recalca: "Los tres y nuestros grupos fuimos necesarios para llegar a estos conocimientos".
La idea de la colaboración surgió por primera vez en 2016 durante una conferencia científica en España, cuando Waldmann y Disney compararon notas después de una charla. Ambos coincidieron en que dirigirse al ARN con fármacos presentaba una posible forma apasionante de atacar enfermedades incurables, pero en aquel momento era pronto. No existía nada parecido en el mercado.
El ARN representaba un difícil reto farmacológico. Con solo cuatro nucleótidos, este ácido nucleico desempeña muchas funciones. Lee genes, ensambla proteínas y se recicla para realizar otras tareas en la célula. Sus estructuras son tan diversas y cambiantes que muchos miembros de la industria farmacéutica descartaron la posibilidad de fabricar medicamentos dirigidos al ARN por considerarla un ejercicio inútil.
Pero a lo largo de 15 años, D. Disney y su grupo han identificado muchas estructuras de ARN conservadas y susceptibles a los fármacos. El equipo de Disney creó sus propias colecciones de compuestos y demostró en ratones que dirigirse a los ARN puede acabar con tumores cancerosos y mejorar otras enfermedades, como la esclerosis lateral amiotrófica (ELA).
El ARN ofrecía una vía alternativa para abordar enfermedades cuyas estructuras proteicas clave no podían ser alcanzadas por los medicamentos.
Tras esa conversación inicial, en 2018 D. Disney envió a dos miembros de su laboratorio, los entonces estudiantes de posgrado a Dortmund para utilizar sus métodos de cribado para cazar posibles candidatos de unión al ARN. Los resultados superaron sus expectativas.
En total, sondearon más de 61 millones de interacciones entre las colecciones de compuestos y el ARN humano. Cuando analizaron los resultados, descubrieron que el universo de estructuras de ARN conocidas y susceptibles a los fármacos se había ampliado drásticamente.
Pero harían falta varios años más de trabajo para relacionar esas estructuras y compuestos con los difíciles objetivos oncológicos MYC, JUN y MIR155. La científica senior Jessica Childs-Disney y el estudiante Yuquan Tong, del laboratorio de Disney realizaron muchos de esos experimentos cruciales.
"Descubrimos que no bastaba con unir estos ARN de las dianas. Eso por sí solo no tenía suficiente impacto. También tuvimos que modificar los compuestos para que pudieran reclutar enzimas de degradación de ARN de moléculas pequeñas", explica Tong.
Disney había ideado un método innovador para eliminar estos segmentos de ARN patógenos. Para ello, unió a las moléculas un anzuelo químico diseñado para atrapar las enzimas de reciclaje de ARN de la célula. Funcionó según lo previsto. La enzima de reciclaje del ARN troceó el ARN al que estaba unida la molécula del fármaco, impidiendo que se formaran las proteínas causantes de la enfermedad. Llamaron a su molécula híbrida RiboTAC (ribonuclease targeting chimera en inglés), una "quimera dirigida a ribonucleasas".
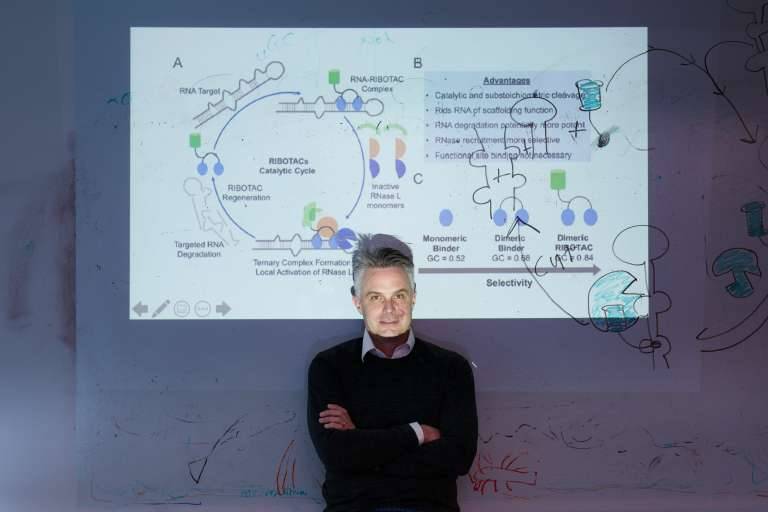
Matthew Disney muestra un esquema de su trabajo con RiboTAC. / Disney lab (The Wertheim UF Scripps Institute)
"Con el degradador añadido, empezamos a ver cómo estos ARN asociados al cáncer y 'no susceptibles a los fármacos' se reducían en un 35 %, 40 %, 50 % o más. Esto provocó la muerte de las células cancerosas y eliminó los tumores en estudios con ratones sobre cáncer de mama que se extendía a los pulmones", señala D. Disney.

Con este compuesto degradador, empezamos a ver cómo ARN asociado al cáncer y no susceptible a los fármacos se reducía hasta en un 50 % o más

El investigador se puso en contacto con un antiguo colega, uno de los principales expertos en la función del MYC en el cáncer, el doctor John Cleveland, director del Moffitt Cancer Center en Tampa, también en Florida.
"Nuestro laboratorio probó la eficacia de los compuestos RiboTAC diseñados para destruir el ARN de MYC y demostró que eliminan eficazmente los linfomas de células B impulsados por este gen, unos tumores muy agresivos y difíciles de tratar", afirma Cleveland, y resume: "Estos resultados (el diseño de degradadores de ARN específicos para desactivar muchos ARN oncogénicos) representan un paso verdaderamente transformador en la terapéutica anticancerosa".
"Por supuesto, los estamos desarrollando aún más, siguiendo nuestro concepto de pseudoproductos naturales", apunta Waldmann, "es un camino largo, una carrera de maratón en realidad".
Como la estrategia es tan novedosa, harán falta más años de trabajo antes de que las innovaciones lleguen a los pacientes a través de un ensayo clínico, añadió.
"Esto es un punto de partida. Nos muestra hacia dónde dirigirnos para crear moléculas pequeñas y medicamentos dirigidos al ARN que podrían llegar a tratar a pacientes con enfermedades como cánceres agresivos que actualmente tienen pocas o ninguna opción", concluye D. Disney, "y, además, este enfoque podría tener aplicaciones en muchas otras enfermedades".
Referencia:
Yuquan Tong, Matthew D. Disney et al. “Programming inactive RNA-binding small molecules into bioactive degraders”. Nature, 2023