La acumulación de proteínas dañadas o mal plegadas puede influir en la calidad de estos óvulos inmaduros. Un estudio en ratones publicado en la revista Cell abre nuevas vías para comprender cómo estos se mantienen sanos y qué provoca que estas estrategias fallen con la edad.
Los ovocitos se desarrollan en casi todas las hembras mamíferas antes del nacimiento. De hecho, la reproducción depende de que esta reserva finita de óvulos inmaduros sobreviva durante muchos años sin sufrir daños. Mientras en ratones puede ser un período de hasta dieciocho meses, en humanos puede durar casi medio siglo (el tiempo promedio hasta la menopausia).
Hasta ahora era un misterio el modo en que las células logran esta hazaña de longevidad. Un equipo del Centro de Regulación Genómica (CRG) de Barcelona ha descubierto un nuevo mecanismo que explica cómo los ovocitos permanecen en perfectas condiciones durante décadas sin sucumbir al desgaste que provocaría en otros tipos celulares.
Los hallazgos, publicados en la revista Cell, representan una nueva frontera para explorar las causas inexplicables de la infertilidad.
El estudio se centra en los agregados de proteínas, que son grupos de proteínas mal plegadas o dañadas. Si no se controlan, estas sustancias nocivas se acumulan en el citoplasma y tienen efectos altamente tóxicos. Así, se almacenan en las neuronas y sus efectos se han relacionado con varias enfermedades neurodegenerativas.
Por lo general, las células manejan los agregados descomponiéndolos con enzimas especializadas. También pueden dividirse en dos nuevas células, concentrando los agregados en una de las células, sin afectar a la otra. Pero los ovocitos no son como las otras células y resultan particularmente sensibles a los efectos de estas proteínas mal plegadas o dañadas.
Sin embargo, “a diferencia de las decenas de miles de artículos sobre la agregación de proteínas en las neuronas, cómo los ovocitos de los mamíferos se enfrentan a ello está esencialmente sin estudiar, a pesar de tener el mismo problema de ser longevos y no dividirse”, explica Elvan Böke, jefa de grupo de Biología de Ovocitos y Latencia Celular del CRG y autora del estudio.
El equipo de Böke, dirigido por Gabriele Zaffagnini, comenzó recolectando miles de ovocitos inmaduros, óvulos maduros y embriones en estado de desarrollo temprano de ratones. Usando tintes especiales, observaron cómo se comportan los agregados de proteínas en tiempo real utilizando una técnica de imagen especial.
Los expertos descubrieron estructuras especiales en los ovocitos a las que llamaron conjuntos vesiculares endolisosomales o ELVA, por su acrónimo en inglés. Estas estructuras (unas 50 por cada ovocito) deambulan por el citoplasma, donde capturan y retienen los agregados proteicos, haciéndolos inofensivos.
El estudio reveló un momento crucial durante la etapa de maduración del ovocito: cuando este se convierte en un óvulo maduro, preparándose para la ovulación y la posible fecundación.

Un ovocito debe donar todo su citoplasma al embrión en el momento de la fecundación, por lo que no puede permitir que se acumule basura, lo que supondría un riesgo existencial para su función

Durante esta etapa, se observó que los ELVA se mueven hacia la superficie de la célula y descomponen los agregados de proteínas, esencialmente limpiando el citoplasma en profundidad. Esta es la primera observación de la singular estrategia que emplean los ovocitos para deshacerse de los agregados de proteínas.
“Un ovocito debe donar todo su citoplasma al embrión en el momento de la fecundación, por lo que no puede permitir que se acumule basura, lo que supondría un riesgo existencial para su función. En ese sentido, los ELVA son como una sofisticada red de eliminación de residuos o un equipo de limpieza que patrulla por el citoplasma para asegurarse de que no haya agregados flotando libremente”, afirma Zaffagnini, coautor.
“Los ELVA mantienen estos agregados en un ambiente confinado hasta que el ovocito esté listo para deshacerse de ellos de una sola vez. Es una estrategia eficaz y eficiente desde el punto de vista energético”, añade.
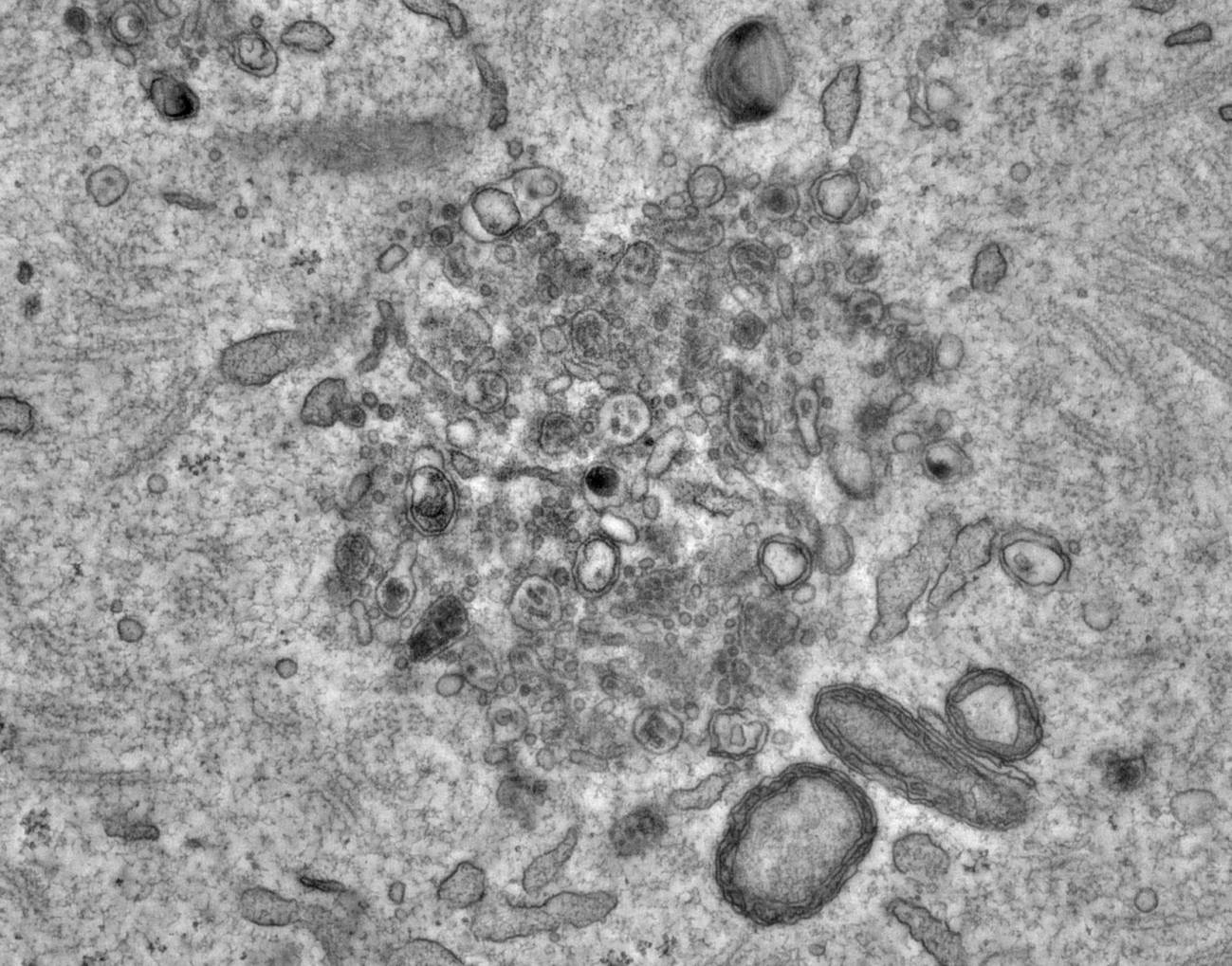
ELVAs fotografiados bajo un microscopio. Este superorgánulo deambula por el citoplasma, capturando y reteniendo agregados de proteínas tóxicas para proteger a los ovocitos. / Weihua Leng/MPI-CBG
Las tasas mundiales de infertilidad están aumentando, siendo el retraso de la maternidad uno de los factores que contribuyen. Comprender cómo los ovocitos se mantienen sanos y qué hace que estas estrategias fallen con la edad es fundamental para comprender las causas inexplicables de este problema y abrir nuevas vías de tratamiento.
Los hallazgos del estudio sugieren que la presencia de agregados proteicos podría interferir con la calidad tanto del óvulo como del embrión.
Cuando los autores eliminaron la capacidad de los ELVA para degradar los agregados de proteínas durante el proceso de maduración de los ovocitos, se produjo la formación de óvulos defectuosos. Es más, cuando el equipo provocó que los embriones heredaran proteínas agregadas, el 60 % no lograron completar etapas muy tempranas de desarrollo.
“Un estudio reciente de once mil transferencias de embriones demostró que la disminución de la fertilidad femenina con la edad está muy influenciada por factores aún desconocidos. Nuestro estudio abre una dirección futura para explorar si la degradación de proteínas y los problemas con la forma en que se regulan en los ovocitos podrían explicar el deterioro de la salud embrionaria relacionado con el tiempo”, concluye Böke.
Referencia:
Zaffagnini et al. “” Cell, 2024. https://doi.org/10.1016/j.cell.2024.01.031