Un equipo estadounidense ha creado el primer modelo tridimensional complejo con funciones y características similares al tejido cortical del cerebro de rata. El modelo será de gran utilidad en investigación de las enfermedades cerebrales, ya que responde a lesiones y a fármacos.
El cerebro sigue siendo uno de los órganos más desconocidos, debido a su complejidad y la dificultad de estudiar su fisiología en vivo. Ahora, un grupo de investigadores de la Universidad de Tufts, en Medford, cerca de Boston (EEUU), ha desarrollado el primer modelo tridimensional complejo con funciones similares al córtex cerebral de una rata.
El nuevo minicerebro artificial tiene la materia blanca y gris compartimentada, muestra respuestas bioquímicas y electrofisiológicas a estímulos y, además, se mantiene vivo en el laboratorio durante más de dos meses.
Los autores del estudio, que se publica esta semana en la revista Proceedings of the National Academy of Sciences (PNAS), señalan que la innovación ofrece nuevas opciones para estudiar la función cerebral y sus enfermedades.
Como primer paso para demostrar el potencial del modelo de tejido cerebral, los investigadores lo usaron para ver los cambios químicos y eléctricos que ocurren inmediatamente después de una lesión traumática del cerebro. También analizaron las modificaciones que se producen en respuesta a un fármaco.
David Kaplan, bioingeniero en la Universidad de Tufts y líder de la investigación, señala que “hay pocas opciones para el estudio de la fisiología del cerebro vivo, pese a que es uno de los campos más importantes de la investigación clínica que busca nuevas opciones para tratar una amplia gama de trastornos neurológicos”.
En lugar de reconstruir una red de todo el cerebro, Kaplan y su equipo ha creado un diseño modular que replica las características fundamentales de mayor relevancia en las funciones fisiológicas de los tejidos del cerebro.
El módulo combina dos materiales con diferentes propiedades: un armazón poroso rígido hecho de un molde de proteína de seda en el que se pueden anclar las neuronas corticales de ratas, y una matriz de gel de colágeno más suave que permite que los axones penetren y se conecten en tres dimensiones. Perforaron como un donut módulos circulares del molde de seda, que luego se ensamblaron en anillos concéntricos para simular las capas laminares del neocórtex.
Siembra de neuronas
Cada capa se sembró con neuronas de forma independiente antes del montaje, sin necesidad de adhesivo o cola. Los donuts se sumergieron entonces en la matriz de gel de colágeno, explican los autores.
La combinación de gel de seda y colágeno proporciona un microambiente óptimo para la formación y funcionamiento de redes neuronales. "La rigidez del biomaterial de seda puede sintonizarse para acomodar a las neuronas corticales y los diferentes tipos de geles, manteniendo la estabilidad del cultivo y una elasticidad parecida a los tejidos del cerebro", señala Min Tang-Schomer, otro de los autores.
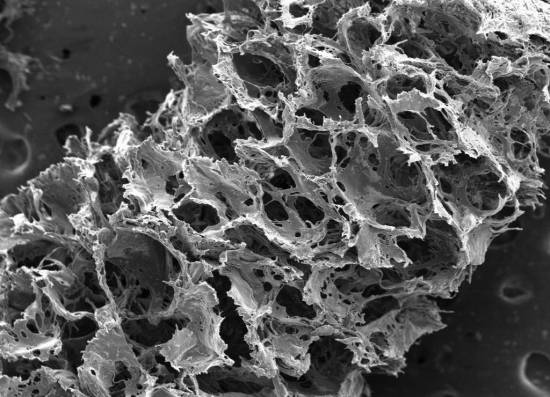
El andamio de seda visto al microscopio electrónico muestra su composición porosa. / Tufts University
Ya existían modelos con neuronas cultivadas en gel 3D, donde pueden establecer conexiones libremente en todas las direcciones, pero en esas condiciones no viven mucho tiempo. "El nuevo tejido mantiene la viabilidad durante al menos nueve semanas, un periodo significativamente más largo que los cultivos hechos de colágeno o de hidrogel por sí solos. También ofrece un soporte estructural para la conectividad de red que es crucial para la actividad cerebral”.
Daño cerebral
Los investigadores usaron el modelo para estudiar el daño cerebral y examinar múltiples efectos posteriores a la lesión, incluyendo el daño celular, la actividad electrofisiológica y cambios neuroquímicos.
Por ejemplo, cuando se dejó caer un peso sobre el modelo de tejido para simular una lesión traumática del cerebro, el tejido liberó altos niveles de glutamato, un neurotransmisor emitido por las células tras el daño cerebral. El modelo también mostró hiperactividad eléctrica transitoria consistente con las respuestas postraumáticas observados in vivo.
"Este modelo ofrece una oportunidad única para mapear eventos neurofisiológicos en tiempo real y estudiar la función cerebral en el laboratorio” destacan los autores.
Kaplan explica que están trabajando para mejorar el modelo, que podrá ser usado también al estudio de la función estructural del cerebro, detección de drogas, el impacto de los electrodos y los implantes sobre la función cerebral, la formación de la enfermedad, tratamientos, y efectos de la nutrición y sustancias tóxicas. "Este es solo el primer paso", concluye.