Durante los primeros meses de la pandemia, el virus SARS-CoV-2 era una enorme incógnita. Sin fármacos ni medicamentos para tratar o curar a los pacientes, encontrar una terapia efectiva pasó a ser prioritario. Multitud de procedimientos fueron modificados para agilizar los ensayos clínicos en pacientes humanos.
Autorizar el uso de un fármaco, y más si se trata de una nueva molécula, siempre ha sido un proceso largo y costoso, con años de ensayos, aciertos y errores. Sin embargo, igual que ha ocurrido con el desarrollo de vacunas, la crisis sanitaria provocada por la covid-19 ha obligado a la comunidad investigadora a aligerar estos procedimientos.
“Nunca habíamos tenido un incremento tan grande en la demanda de medicamentos. Algunos multiplicaron la solicitud habitual por diez”, declara a SINC César Hernández, jefe del Departamento de Medicamentos de Uso Humano de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). “Cuando la mayor parte de la actividad estaba parada, movilizar a transportistas, laboratorios o proveedores de materias primas supuso un gran esfuerzo, pero tuvimos una espléndida colaboración por parte de todos”, comenta.
Entre marzo y abril, cuando la pandemia golpeó con más fuerza, buena parte de la actividad de la institución derivó tanto a asegurar el uso de fármacos como a garantizar su investigación para el tratamiento del coronavirus.
“Era inaceptable que se produjera un desabastecimiento de medicamentos o que se propusieran investigaciones y no hubiera respuesta casi en el momento. Por ello, nos propusimos conseguir recursos extra para sacar adelante todas estas actividades”, recuerda Hernández.
Según el experto de la AEMPS, esta premura por descubrir qué medicamentos podrían ser más efectivos para el nuevo virus no afectó a la calidad y la exigencia de los ensayos clínicos. “No se ha producido ningún cambio en cómo se prestan las garantías; no ha habido diferente rasero”, certifica.
“Hay que generar evidencia lo antes posible para facilitar un acceso temprano a la medicación, ya que puede suponer la salvación. Pero también debes asumir una mayor incertidumbre si lo haces demasiado pronto. Por ello, tienes que encontrar un equilibrio apropiado que beneficie a la salud pública”, añade Hernández.
Pocos días después de que se decretase el estado de alarma (14 de marzo), la AEMPS se puso en contacto con promotores e investigadores para ofrecerles asesoría científica y reguladora. El objetivo era acelerar la investigación en esta área ante el colapso sanitario que ya comenzaba a producirse.
Tal y como relata Hernández, todos los días –incluyendo sábados y domingos– se producía una reunión en la agencia para evaluar qué ensayos clínicos habían llegado nuevos. “Hemos sido más proactivos, eso sí ha cambiado. Conforme llegaban las propuestas, se evaluaban. Antes tardábamos más de 90 días en aprobar un ensayo clínico. Durante la covid-19, probablemente hemos estado por debajo de los 30 días”, explica.
Hasta la llegada del SARS-CoV-2, lo habitual era que la mayoría de ensayos se promoviesen desde la industria farmacéutica. Sin embargo, los datos del Ministerio de Sanidad sostienen que la tendencia se invirtió en estos meses y la iniciativa pública pasó a ser el mayor promotor de ensayos clínicos. Aunque a día de hoy la proporción de ensayos públicos y privados se sitúa en un 60,9 % frente a un 30,1 %, la actividad pública alcanzó el 80 % en algunos momentos.
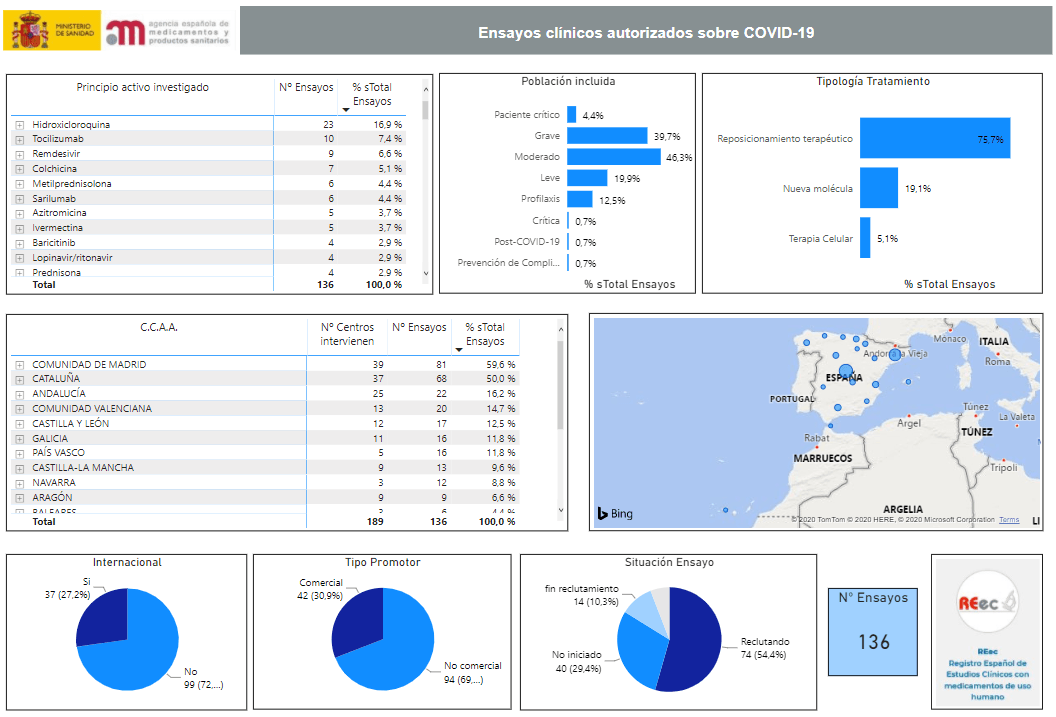
Visualización de datos sobre ensayos clínicos de covid autorizados por la AEMPS
“Con la llegada de la pandemia nos dimos cuenta de que este proceso era incompatible con las necesidades que teníamos para obtener conocimiento. Por muy sencillo que fuese, la puesta en marcha de un ensayo podía llevar entre 4 y 5 meses”, declara a SINC Antonio Portolés Pérez, jefe de sección de farmacología clínica en el Hospital Clínico San Carlos.
La institución en la que trabaja Portolés ha sido una de las muchas que han promovido la elaboración de ensayos clínicos en busca de tratamientos efectivos durante la pandemia. De hecho, el propio Hospital Clínico San Carlos participó en el conocido ensayo Solidarity, promovido por la Organización Mundial de la Salud (OMS).
“En ese momento se habilitaron procesos extraordinarios para evaluar de forma inmediata las propuestas para investigar sobre covid, para tramitar las autorizaciones una vez evaluadas, para obtener financiación para proyectos de investigación…”, considera Portolés. Sin embargo, el especialista encuentra “inviable” que estos procesos extraordinarios se vayan a instalar de forma habitual.
“Puedes priorizar y hacer que toda la comunidad científica, evaluadora y administrativa se centre en un problema, pero lógicamente vas a dejar otras patologías y cuestiones olvidadas que no van a recibir el mismo empuje”, subraya.
Otro de los aspectos clave para conseguir medicamentos útiles durante la pandemia ha sido el tratar de reposicionar fármacos ya autorizados en lugar de desarrollar nuevas moléculas, ya que sería un proceso “largo e inabordable para una pandemia como esta”, indica Portolés. “Era preferible hacer ensayos con un medicamento que ya se sabía seguro y que estaba distribuido en todos los países del mundo, que empezar desde cero”.
“Las decisiones iniciales sobre estos fármacos se tomaron según las características que se empezaron a observar en el virus. Es decir, por dónde entraba, qué tipo de receptores utilizaba o qué estructura tenía fueron preguntas clave para relacionar medicamentos que actuaran sobre esas estructuras, enzimas o mecanismos de acción. Si tuviéramos que probar cada una de las 12.000 sustancias existentes, no nos daría tiempo”, ejemplifica el responsable del Hospital Clínico San Carlos.
Tocilizumab, colchicina, metilprednisolona, etc. A pesar de que el más conocido pueda ser la hidroxicloroquina, en España se han autorizado ensayos con un total de 103 medicamentos ya existentes para otros usos. Suponen, según datos de la AEMPS, el 75,7 % de los ensayos clínicos autorizados en España sobre la covid-19, frente al 19,1 % a partir de nuevas moléculas y al 5,1 % que se llevan a cabo con terapias celulares.
Sobre el diseño de los propios ensayos, Portolés recalca que durante esta pandemia se ha fomentado el ensayo de tipo adaptativo “para hacer modificaciones en función de lo que ocurriera en una primera parte de este”, señala. “Esto ha demostrado una gran capacidad de flexibilidad, haciendo que el ensayo se pudiese adecuar si un brazo tenía que desaparecer o, por el contrario, incorporar brazos nuevos. Lógicamente esto es laborioso, pero se puede aprovechar gran parte del trabajo que se lleva realizado”, expone.
El paciente debe conocer los riesgos a los que se expone al participar en un ensayo./ Adobe Stock
Uno de los aspectos primordiales a la hora de llevar a cabo un ensayo consiste en velar por el bienestar del sujeto participante, sin que se produzca un abuso por parte de los promotores. Ahí, el papel de los Comités Éticos de Investigación (CEIm) ha supuesto un papel fundamental durante esta pandemia.
“El CEIm evalúa varios aspectos del protocolo del ensayo, como administrativos y legales. Al sujeto que va a participar se le debe informar bien de las consecuencias y riesgos a los que puede exponerse, de la cobertura de seguros, del material de reclutamiento, de todos sus derechos...”, explica a SINC Emma Fernández de Uzquiano, secretaría técnica del CEIm del Hospital Universitario La Paz (IdiPAZ) y doctora en medicina.
Además de esta labor informativa, desde los CEIm se vela por que los ensayos se desarrollen según su protocolo mediante la vigilancia y seguimiento de las actuaciones. Una labor que con la pandemia se ha visto obligada a reinventarse.
“Nos dijeron que se permitían las reuniones por videoconferencia ad hoc para evaluar los protocolos”, relata Fernández de Uzquiano. Precisamente, la utilización de la tecnología ha permitido a los comités ejercer su trabajo reduciendo el perjuicio para los pacientes.
Desde la AEMPS, se recomendó a los promotores priorizar la monitorización remota para los ensayos clínicos que investigasen la prevención o el tratamiento de la covid-19, con el objetivo de no “sobrecargar de tareas al personal del centro”.
También se ha cambiado la manera de recabar el consentimiento de los pacientes para ser incluidos en el ensayo. “Lo normal es que se firme un documento y se entregue una copia al paciente. En ese momento, no se quiso utilizar papel porque no se sabía si podía ser una fuente de contaminación. Tampoco podían estar presentes los familiares cuando el paciente estaba más grave, ni había un testigo para acreditar que se estaba informando correctamente al paciente”, recuerda la secretaria técnica del CEIm de La Paz.
Tal y como se avaló desde la AEMPS, el consentimiento puede obtenerse de manera oral y preferiblemente ante un testigo (siempre que la situación epidemiológica de la pandemia lo permita). “En situaciones de urgencia, con pacientes sin capacidad de consentir, se ha seguido lo que estipula el Real Decreto 1090/2015”, detalla Uzquiano.
Según su artículo 7, “podrá someterse a una persona a un ensayo clínico sin obtener el consentimiento informado previo [...] la persona, o su representante legalmente designado será informado en cuanto sea posible y deberá otorgar su consentimiento para continuar en el ensayo, si procediera, o ratificarlo en todo caso”.
“Se necesitaba tener resultados de calidad, y de cuantos más pacientes mejor, para saber si lo que se estaba utilizando para el coronavirus era eficaz o no”, añade Uzquiano. “Los voluntarios querían participar para comprobar si algo funcionaba, pero en ningún caso se les retiraba el tratamiento de base”.
“En aquel momento no se sabía qué podía servir a las personas afectadas, pero toda la gente quería ayudar para aprender cómo tratar mejor la enfermedad, pensando en sus familiares o allegados. Todos tuvimos que poner nuestro granito de arena”, concluye.