Un equipo de científicos de EE UU ha desvelado la cambiante estructura molecular de las proteínas que usa el virus del sida para unirse a las membranas de las células e infectarlas. El hallazgo puede ayudar a diseñar vacunas para tratar la enfermedad.
La capa exterior del VIH presenta unas prolongaciones formadas por las glicoproteínas gp120 y gp41 que actúan en el momento de la unión del virus a la célula huésped. Tres conjuntos de estas dos moléculas constituyen los 'ganchos' proteicos del VIH, que adoptan diferentes configuraciones antes y después de que el virus se fusione con la célula. Las estructura atómica del estado denominado de prefusión de gp120 y el de postfusion de gp120 y gp41 ya se habían determinado.
Ahora, después de más de una década de estudios, una nueva investigación completa el escenario del acoplamiento con la descripción atómica de la configuración que faltaba: la prefusión de gp41, además de describir los movimientos que ejecuta el complejo proteico para engancharse a la célula. Los detalles los publican a la vez en las revistas Nature y Science científicos de los Institutos Nacionales de Salud, el Weill Cornell Medical College y la Escuela de Medicina de la Universidad de Yale de EE UU.
Sus descubrimientos hacen ahora evidente cómo todo el gancho proteico se reorganiza cuando el virus se fusiona con la membrana celular, de tal forma que el mecanismo que usa el VIH para evitar la detección por el sistema inmunológico es más claro. Según los autores, estos hallazgos podrían ayudar en el desarrollo de vacunas y tratamientos contra el VIH.
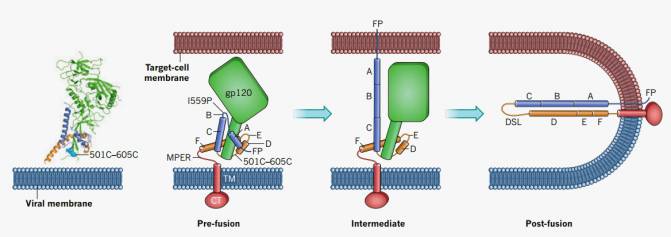
Modelo de la fusión del VIH a la membrana celular, donde se observan los cambios de configuración del complejo proteico con las subunidades gp120 (verde) y gp41 (rojo, azul y marrón). / Rogier W. Sanders & John P. Moore/Nature
Los investigadores han utilizado una sofisticada técnica para ver cómo las proteínas implicadas se mueven antes y durante la unión celular. Encontraron que cuando están en el modo ‘desatado’ o sin unir, cambian rápidamente entre tres configuraciones diferentes. La forma predominante, denominada como 'estado cerrado o base' y descrito ahora a nivel atómico, es difícil de detectar por el sistema inmune, y sólo los anticuerpos ampliamente neutralizantes se unen a ella.
En esta forma, el gancho se adhiere bien a sólo uno de los dos receptores celulares a los que debe unirse el VIH para luego fusionarse con la célula. Cuando los anticuerpos ampliamente neutralizantes y los fármacos que inhiben la entrada se juntan al VIH, a menudo estabilizan el gancho en el estado base, y por tanto impiden que el virus infecte la célula.
Según los autores, estos hallazgos, tomados en conjunto, indican que una vacuna eficaz contra el VIH que enseñe al sistema inmune a neutralizar al virus debería basarse en este estado cerrado, es decir, en el estado de prefusión del gancho. El conocimiento de la estructura atómica de toda la configuración proteica implicada ofrece a los investigadores las herramientas necesarias para diseñar y manipular componentes de una posible vacuna contra el sida.
Referencias bibliográficas:
James B. Munro et al. “Conformational dynamics of single HIV-1 envelope trimers on the surface of native virions”. Science, 8 de octubre de 2014.
M. Pancera, P. D. Kwong et al. “Structure and immune recognition of trimeric pre-fusion HIV-1 Env”. Nature, 8 de octubre de 2014.