Los científicos Jacques Dubochet, Joachim Frank y Richard Henderson son los ganadores del Premio Nobel de Química 2017 por el desarrollo de la criomicroscopía electrónica, que permite visualizar y estudiar biomoléculas en alta resolución. Se trata de un avance trascendental en bioquímica, que ayudará a comprender mejor la química de los seres vivos y desarrollar nuevos fármacos.
Pronto se podrán obtener imágenes a resolución atómica de la compleja maquinaria de la vida gracias a los ganadores del Premio Nobel de Química de este año: Jacques Dubochet, de la Universidad de Lausana (Suiza); Joachim Frank, de la Universidad de Columbia (EE UU); y Richard Henderson, del MRC Laboratory of Molecular Biology de Cambridge (Reino Unido).
La Academia Sueca de las Ciencias se lo ha otorgado hoy "por el desarrollo de la criomicroscopía electrónica, que permite determinar en alta resolución las estructuras de biomoléculas en solución". Este método, que simplifica y mejora la obtención de imágenes de las moléculas de la vida, ha llevado a la bioquímica a una nueva era.
Las imágenes son claves para entender cualquier proceso. Los descubrimientos científicos a menudo se basan en poder visualizar bien los objetos que son invisibles al ojo humano. Sin embargo, hasta la fecha los 'mapas' bioquímicos se han llenado de espacios en blanco porque la tecnología disponible tenía dificultades para generar imágenes de gran parte de la maquinaria molecular de la vida.
Pero ahora la llamada criomicroscopia electrónica lo cambia todo. Los científicos pueden congelar las biomoléculas en pleno movimiento y visualizar procesos que nunca antes se habían visto, lo que es decisivo tanto para la comprensión básica de la química de la vida como para el desarrollo de productos farmacéuticos.
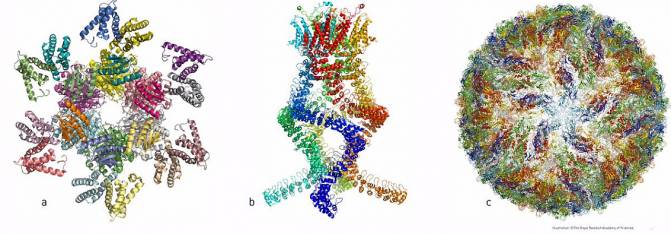
Ejemplos de estructuras atómicas de biomoléculas conseguidas con criomicroscopia electrónica : a) proteína que controla los ritmos circadianos, b) sensor auditivo y c) virus del Zika. / The Royal Swedish Academy of Sciences
Durante mucho tiempo se pensó que los microscopios electrónicos solo eran adecuados para captar imágenes de materia muerta, ya que el poderoso haz de electrones que emplea destruye el material biológico. Pero en 1990, el escocés Richard Henderson (Edimburgo, 1945) logró por fin utilizar uno de estos microscopios para generar una imagen tridimensional de una proteína a resolución atómica. Este avance demostró el potencial de la técnica.
Fusión de imágenes difusas 2D para crear una nítida 3D
Por su parte, el químico alemán Joachim Frank (Siegen, 1940) hizo que esta tecnología se pudiera aplicar de forma general. Entre 1975 y 1986 desarrolló un método de procesamiento de imágenes en el que se analizan las fotografías bidimensionales difusas que toma el microscopio electrónico y después se fusionan para revelar una estructura tridimensional definida.
Y la aportación del suizo Jacques Dubochet (Aigle, 1942) fue el uso del agua en la microscopía electrónica. El agua líquida se evapora en el vacío que se genera dentro de estos avanzados microscopios, lo que hace que las biomoléculas colapsen. Sin embargo, a principios de los años ochenta, Dubochet consiguió vitrificar el agua: la enfrió con tanta rapidez que se solidificó en su forma líquida alrededor de una muestra biológica, permitiendo así que las biomoléculas conserven su forma natural, incluso en el vacío.
Después de estos descubrimientos, se han optimizado todas las piezas del microscopio electrónico. La resolución atómica que ansiaban los científicos se alcanzó en 2013, y ahora se pueden producir de forma rutinaria las estructuras tridimensionales de las biomoléculas.
En los últimos años, la literatura científica se ha llenado de imágenes de todo tipo, desde proteínas que causan resistencia a antibióticos hasta la superficie del virus Zika. Como señala la Academia Sueca de las Ciencias en un comunicado, "la bioquímica se enfrenta ahora a un desarrollo explosivo, pero está preparada para ese futuro emocionante".
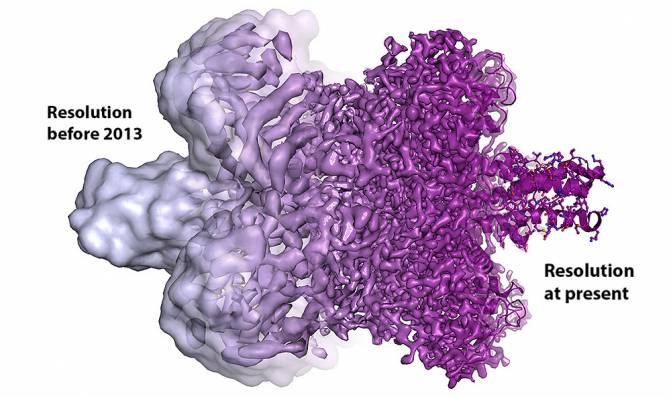
Evolución de la resolución de una biomolécula desde antes de 2013 a la actualidad. / Martin Högbom/The Royal Swedish Academy of Sciences