Un grupo de investigadores del Centro Nacional de Biotecnología ha descubierto un mecanismo por el que la bacteria patógena Listeria monocytogenes aumenta la expresión de una proteína de su pared cuando crece dentro de células eucariotas. Las infecciones causadas por la bacteria poseen una mortalidad del 20-30%.
Con una mortalidad estimada de un 20-30%, las infecciones por L. monocytogenes progresan rápidamente debido a que el patógeno es capaz de cruzar las barreras de defensa (epitelio intestinal, placenta, barrera hematoencefálica). A continuación, la bacteria invade las células del hospedador y prolifera dentro de ellas.
Las bases moleculares que sustentan la capacidad de L. monocytogenes para adaptarse y vivir dentro de células eucariotas son en gran medida desconocidas. No obstante, datos recientes obtenidos por técnicas de proteómica y transcriptómica muestran una expresión selectiva de determinados genes y proteínas cuando el patógeno crece en el interior de la célula hospedadora.
Dirigidos por el microbiólogo del Centro Nacional de Biotecnología Francisco García-del Portillo, un grupo de científicos acaba de publicar en la revista PLOS Genetics un mecanismo de regulación de una proteína anclada a la pared bacteriana de L. monocytogenes por parte de un “ARN pequeño”.
Este proceso culmina con la producción preferencial de la proteína solo cuando el patógeno crece en la célula eucariota. En colaboración con la investigadora de la Universidad Autónoma de Madrid, Graciela Pucciarelli, han descubierto que “esta especificidad se consigue porque las bacterias intracelulares transcriben una variante del ARN mensajero que contiene una región no traducida (UTR) en el extremo 5’, inusualmente larga (234 nucleótidos), a la que podría unirse el ARN regulador”.
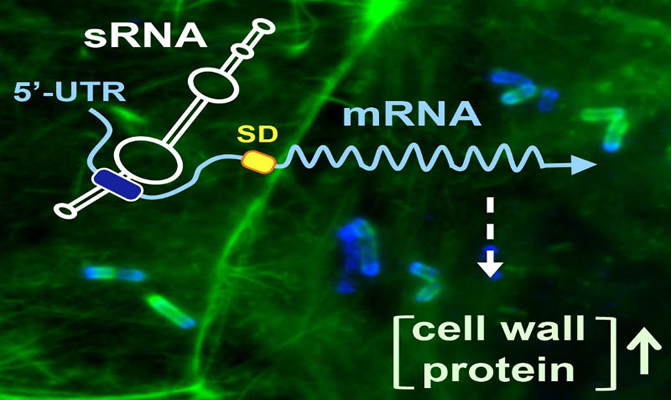
Mecanismo de regulación que actúa produciendo la expresión de la proteína de la pared bacteriana cuando Listeria crece en el interior de células eucariotas. / Francisco García-del Portillo (CNB)
Esta regulación ‘espacial’ consigue que la producción de esta proteína esté fuertemente apagada cuando la bacteria crece en medios de laboratorio. La situación se invierte en la bacteria intracelular, cuando se produce de forma mayoritaria una variante del ARN mensajero reconocida por el ARN regulador.
Reforzando este mecanismo, los autores describen que la bacteria intracelular aumenta la cantidad del ARN pequeño Rli27 durante el ciclo infectivo. Según explica García-del Portillo, el aumento de ambos elementos en respuesta a la infección, tanto del ARN regulador (Rli27) como de la variante del ARN mensajero del gen diana que expone un sitio de unión para ese ARN, asegura que “esta proteína de superficie del patógeno se produzca de forma selectiva dentro de la célula hospedadora” en lugar del ambiente extracelular.